HPV – Tudo o que você precisa saber
Confira o artigo da Dra. Adriana Bittencourt Campaner (CRM-SP: 75.482) e atualize seus conhecimentos sobre o papilomavírus humano (HPV)
Atualmente, a vacina papilomavírus humano 6, 11, 16 e 18 (recombinante), isto é, vacina quadrivalente (4V) é aprovada pela Agência Nacional de Vigilância Sanitária (ANVISA) para utilização no Brasil para uso adulto e pediátrico, ou seja, para meninas e mulheres entre 9 a 45 anos de idade e meninos e homens de 9 a 26 anos de idade.1
Para meninas e mulheres é indicada na prevenção de: infecções e lesões anormais e pré-cancerosas do colo do útero, vagina, vulva e ânus causadas pelos tipos de papilomavírus humano (HPV) 6, 11, 16 e 18; cânceres de colo do útero, vulva, vagina e ânus causados pelos tipos de HPV 16 e 18; verrugas genitais causadas pelos tipos de HPV 6 e 11.1
Em relação aos meninos e homens, protege contra as seguintes doenças causadas pelo HPV: lesões genitais externas anormais e pré-cancerosas, lesões do ânus e infecções causadas pelos tipos de HPV 6, 11, 16 e 18; câncer de ânus causado pelos tipos de HPV 16 e 18; verrugas genitais causadas pelos tipos de HPV 6 e 11. Nos estudos de eficácia da vacina 4V, que comprovaram formação de anticorpos em quase 100% da população estudada e eficácia clínica muito elevada, foram utilizadas três doses em todas as faixas etárias, sendo a segunda dose dois meses após a primeira e a terceira dose seis meses do início (0 – 1 a 2 – 6 meses).1-3
A partir de março de 2014, a vacina 4V passou a ser ofertada gratuitamente no Sistema Único de Saúde (SUS), isto é, pelo Programa Nacional de Imunização (PNI). Atualmente, a população-alvo prioritária da vacina HPV nesse programa é a de meninas na faixa etária de 9 a 15 anos incompletos, meninos de 11 a 15 anos incompletos e mulheres e homens vivendo com HIV, pacientes transplantados e oncológicos em uso de quimioterapia e radioterapia, na faixa etária de 9 a 26 anos. O esquema de vacinação do Ministério da Saúde (MS) contra o HPV para adolescentes é composto apenas por duas doses, sendo a segunda aplicada com intervalo de seis meses após a primeira dose. Para imunossuprimidos são indicadas três doses da vacina. Para as demais pessoas não incluídas no PNI, a vacina 4V pode ser encontrada no mercado privado, disponível em clínicas de vacinação e laboratórios.4,5
Referências bibliográficas: 1. Bula vigente de GARDASIL. 2. Garland SM, Hernandez-Avila M, Wheeler CM et al; Females United to Unilaterally Reduce Endo/Ectocervical Disease (FUTURE) I Investigators. Quadrivalent vaccine against human papillomavirus to prevent anogenital diseases. N Engl J Med. 2007;356(19):1928-43. 3. FUTURE II Study Group. Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions. N Engl J Med. 2007 2007;356(19):1915-27. 4. Sociedade Brasileira de Imunizações (SBIm). Calendários de vacinação. Disponível em: https://sbim.org.br/calendarios-de-vacinacao. Acessado em 23 de abril de 2021. 5. Sociedade Brasileira de Imunizações (SBIm). Vacina HPV4. 2020. Disponível em: https://familia.sbim.org.br/vacinas/vacinas-disponiveis/vacina-hpv4. Acessado em 30 de abril de 2021.
Como mencionado anteriormente, a vacina 4V em nosso país é aprovada para meninas e mulheres entre 9 e 45 anos e para meninos e homens entre 9 e 26 anos. Como a população-alvo do PNI inclui uma faixa etária restrita, muitas pessoas encontram-se fora da cobertura do PNI. Assim, se alguém desejar receber a vacina, pode procurar a mesma no mercado privado.1 Mas vale a pena tomar a vacina?
Queremos enfatizar que o HPV anogenital é a infecção viral mais frequente transmitida sexualmente no mundo. Estima-se que o número global de mulheres infectadas por esse vírus chegue a 291 milhões. A taxa de incidência anual mundial reportada de verrugas anogenitais varia de 100 a 200 novos casos por 100.000 da população adulta em geral. No Brasil, a prevalência geral de infecção do colo do útero pelo HPV varia entre 13,7 e 54,3% e o câncer de colo uterino ocupa a 3ª posição de ocorrência.2,3
O vírus é transmitido pelo contato direto com a pele ou mucosas infectadas, sendo o risco de contágio bastante elevado; o preservativo não protege da infecção em 100% dos casos. Após período de incubação variável, diversos tipos de lesões clínicas relacionadas ao trato anogenital podem surgir: lesões papulosas pequenas, queratoses, lesões vegetantes (verrugas/condilomas) e tumorações gigantes (tumor de Buschke-Lowenstein), todas relacionadas aos HPV de baixo risco oncogênico (tipos 6 e 11 em 90% dos casos). Já os tipos de alto risco oncogênico podem causar lesões pré-cancerosas e tumores invasivos anogenitais, incluindo ânus, pênis, vulva, vagina e colo uterino (70% casos do câncer de colo relacionados aos tipos 16 e 18). Assim, podemos pressupor que muitas pessoas se encontram infectadas pelo HPV e qualquer indivíduo, independentemente de idade, sexo e classe social, pode se contaminar facilmente com o vírus e desenvolver esses diversos tipos de lesões anogenitais de maneira inesperada. Com o emprego da vacina 4V, haveria proteção eficaz contra os 4 principais tipos virais relacionados às verrugas e aos cânceres anogenitais.4,5
Referências bibliográficas: 1. Sociedade Brasileira de Imunizações (SBIm). Vacina HPV4. 2020. Disponível em: https://familia.sbim.org.br/vacinas/vacinas-disponiveis/vacina-hpv4. Acessado em 30 de abril de 2021.2. Moscicki AB, Schiffman M, Burchell A et al. Updating the natural history of human papillomavirus and anogenital cancers. Vaccine. 2012;30(Suppl5):F24-33. 3. Ayres AR, Silva GA. Cervical HPV infection in Brazil: systematic review. Rev Saúde Pública .2010; 44(5):963-74. 4. de Sanjosé S, Brotons M, Pavón MA. The natural history of human papillomavirus infection. Best Pract Res Clin Obstet Gynaecol. 2018;47:2-13. 5. Bula vigente de GARDASIL.
Atualmente muitos pais perguntam qual seria a melhor idade para vacinar seus filhos. Inicialmente, gostaríamos de destacar alguns dados sobre a imunogenicidade da vacina 4V, ou seja, sobre a sua capacidade de induzir a formação de anticorpos. Os principais estudos de eficácia da vacina mostraram que a resposta imune humoral (títulos/níveis de anticorpos) contra os 4 sorotipos virais contidos na vacina (HPVs 6, 11, 16 e 18) é maior quanto mais cedo o(a) adolescente for vacinado(a) (Figura 1.).1,2
Vale a pena lembrar que os jovens na atualidade estão iniciando sua atividade sexual cada vez mais cedo. A idade mediana de início da atividade sexual dos(as) adolescentes hoje, no Brasil, é de 14 anos e durante os primeiros anos de atividade sexual, a mudança de parceiros(as) costuma ser frequente, bem como o não uso de preservativos. No mundo, esses dados são semelhantes. Isso mostra que os jovens estão expostos e podem contrair múltiplos sorotipos de HPV e outras infecções sexualmente transmissíveis (ISTs). A transmissão do HPV não ocorre apenas pela via sexual. Há transmissão entre as mãos e os genitais, e casos de autoinoculação descritos na literatura.3-5
Um estudo realizado por Shew ML e colaboradores acompanhou longitudinalmente uma coorte de adolescentes do sexo feminino, sem nenhuma relação sexual vaginal prévia, com o intuito de avaliar a frequência de detecção de HPV vaginal e a associação entre a primeira detecção de HPV relatada e os comportamentos sexuais, excluindo-se o coito. No acompanhamento, o HPV foi detectado em 45,5% das jovens (10 de 22) antes do primeiro sexo vaginal com penetração. Sete dessas mesmas jovens relataram comportamentos sexuais que não o coito, os quais, em parte, poderiam explicar a transmissão genital.6
Um estudo realizado por Shew ML e colaboradores acompanhou longitudinalmente uma coorte de adolescentes do sexo feminino, sem nenhuma relação sexual vaginal prévia, com o intuito de avaliar a frequência de detecção de HPV vaginal e a associação entre a primeira detecção de HPV relatada e os comportamentos sexuais, excluindo-se o coito. No acompanhamento, o HPV foi detectado em 45,5% das jovens (10 de 22) antes do primeiro sexo vaginal com penetração. Sete dessas mesmas jovens relataram comportamentos sexuais que não o coito, os quais, em parte, poderiam explicar a transmissão genital.6
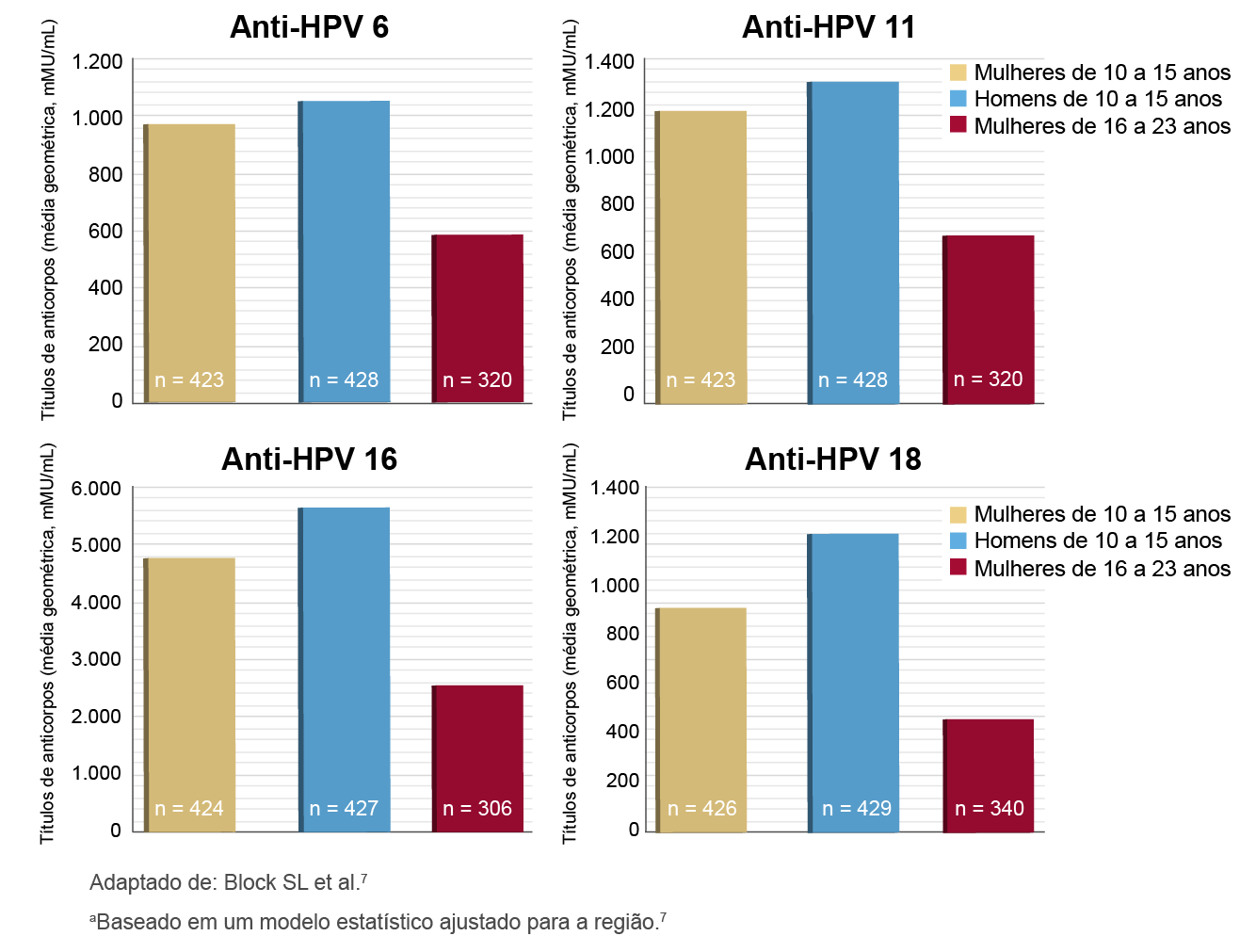
Figura 1. Títulos de anticorpos induzidos contra o HPV em meninas e meninos versus em mulheres no 7º mês de acompanhamento (títulos não inferiores na população por protocolo):7,a
Os autores concluíram que o HPV pode ser detectado na vagina antes da primeira relação sexual, destacando a necessidade da vacinação precoce contra esse vírus.7
Bacopoulou F e colaboradores compararam a prevalência da infecção genital pelo HPV entre crianças pré-púberes e adolescentes sexualmente ativas e não sexualmente ativas, avaliando os potenciais fatores de risco para a transmissão viral. Noventa e cinco meninas de 2 a 21 anos foram incluídas: 38 adolescentes sexualmente ativas (grupo A), 28 adolescentes não sexualmente ativas (grupo B) e 29 crianças pré-púberes (grupo C). O HPV genital foi detectado em 37,9% (36/95) de todos as participantes, sendo 47,4% (18/38) do grupo A, 28,6% (8/28) do grupo B e 34,5% (10/29) do grupo C (p = 0,27). A infecção múltipla por HPV foi detectada em 26,3% (10/38), 10,7% (3/28) e 13,8% (4/29) dos grupos A, B e C, respectivamente (p = 0,21). Os genótipos de alto risco foram detectados em 47,4% (18/38), 28,6% (8/28) e 24,1% (7/29) dos grupos A, B e C, respectivamente (p = 0,10). Os principais genótipos de alto risco detectados foram: 16 (27%, 10/37), 31 (21,6%, 8/37), 35 (13,5%, 5/37), 53 (13,5%, 5/37) e o 6 de baixo risco (18,9%, 7/37). Os autores concluíram que a época e a população-alvo para a vacinação contra o HPV necessitam ser reavaliadas, tendo em vista a transmissão não sexual significativa de HPV genital tão cedo na infância.8
Do exposto, podemos sugerir que a vacinação contra o HPV deve ser iniciada o mais cedo possível, explicando-se aos pais os benefícios da vacinação precoce.2-8
Referências bibliográficas: 1. Bula vigente de GARDASIL 2. Garland SM, Hernandez-Avila M, Wheeler CM et al; Females United to Unilaterally Reduce Endo/Ectocervical Disease (FUTURE) I Investigators. Quadrivalent vaccine against human papillomavirus to prevent anogenital diseases. N Engl J Med. 2007;356(19):1928-43. 3. Gonçalves H, Machado EC, Soares AL et al. Sexual initiation among adolescents (10 to 14 years old) and health behaviors. Rev Bras Epidemiol. 2015;18(1):25-41. 4. World Health Organization (WHO). Health policy for children and adolescents, nº 4. Young people’s health in context. Health Behaviour in School-aged children (HBSC) study: international report from the 2001/2002 survey. 2004. Disponiível em: https://www.who.int/immunization/hpv/target/young_peoples_health_in_context_who_2011_2012.pdf. Acessado em 14 de maio de 2021. 5. Hernandez BY, Wilkens LR, Zhu X et al. Transmission of human papillomavirus in heterosexual couples. Emerg Infect Dis. 2008;14(6):888-94. 6. Shew ML, Weaver B, Tu W et al. High frequency of human papillomavirus detection in the vagina before first vaginal intercourse among females enrolled in a longitudinal cohort study. J Infect Dis. 2013;207(6):1012-5. 7. Block SL, Nolan T, Sattler C et al; Protocol 016 Study Group. Comparison of the immunogenicity and reactogenicity of a prophylactic quadrivalent human papillomavirus (types 6, 11, 16, and 18) L1 virus-like particle vaccine in male and female adolescents and young adult women. Pediatrics. 2006;118(5):2135-45. 8. Bacopoulou F, Karakitsos P, Kottaridi C et al. Genital HPV in children and adolescents: does sexual activity make a difference? J Pediatr Adolesc Gynecol. 2016;29(3):228-33.
Alguns pais têm evitado a administração da vacina contra o HPV por receio de que a aplicação da vacina pudesse estimular o início precoce da atividade sexual.
Gostaria de apresentar um estudo desenvolvido por Rysavy et al., cujo objetivo foi comparar as atitudes e os comportamentos sexuais de mulheres jovens que receberam ou que declinaram da vacina contra o HPV. Foram incluídas 223 mulheres jovens (13-24 anos): 153 que receberam vacinação contra HPV e 70 sem vacinação prévia contra o vírus. Verificou-se que as jovens vacinadas eram pouco mais jovens do que as não vacinadas (média de idade 19,2 vs. 20,0 anos).1
Ambos os grupos apresentaram grande porcentagem de participantes envolvidas em comportamentos sexuais de alto risco (75% vs. 77%). A média de idade no início da atividade sexual não foi significativamente diferente entre os grupos (16,8 vs. 17,0 anos), nem o número médio de parceiros sexuais (6,6 para ambos). As participantes não vacinadas apresentaram maior probabilidade de engravidar (20% vs.. 8,6%, P = 0,016), embora essa diferença não tenha sido significativa na análise multivariada IC [0,902-5,177]. Perguntas específicas sobre comportamentos e atitudes sexuais de alto risco não revelaram diferenças significativas entre os grupos. Por fim, os autores enfatizam que os comportamentos sexuais, incluindo os de alto risco, eram semelhantes entre mulheres jovens que receberam ou não a vacinação contra HPV. Essas descobertas não fornecem apoio às diversas sugestões de que a vacina esteja associada ao aumento da atividade sexual. De maneira importante, descobriu-se que as mulheres jovens se tornam sexualmente ativas em uma idade jovem, além de envolvidas em comportamentos de alto risco, o que afirma a importância da vacinação precoce.1
Um outro estudo semelhante ao anterior incluiu um total de 3.805 mulheres que relataram ter recebido a vacina contra o HPV e 40.247 que relataram não a ter recebido. Observou-se que a vacinação contra o HPV não resultou em idade mais jovem na primeira relação sexual. As mulheres que receberam a vacina contra o HPV antes ou na mesma idade que a estreia sexual não tinham maior número de parceiros sexuais do que as não vacinadas. A não utilização de contracepção durante a primeira relação sexual foi mais comum entre as não vacinadas do que entre as vacinadas contra o HPV. Concluiu-se que as mulheres que receberam a vacina contra o HPV antes ou na mesma idade da estreia sexual não se envolveram mais em comportamentos de risco sexual do que as mulheres que não receberam a vacina contra o HPV.2
Outros estudos descritos na literatura, como os de Ruiz-Sternberg AM e colaboradores, conduzido em 2014, e Kumakech E e colaboradores, conduzido, em 2017, também relatam não haver diferenças significativas entre os grupos vacinados e não vacinados contra HPV quanto à prevalência de comportamentos sexuais de alto risco. Mediante os estudos apresentados, pode-se concluir que a vacinação contra o HPV não estimula o início precoce da atividade sexual. A vacina deve ser orientada pelo médico aos seus pacientes adolescentes, visto que adolescentes praticam comportamentos sexuais de risco em idade jovem e sem proteção.1-4
Referências bibliográficas: 1. Rysavy MB, Kresowik JD, Liu D et al. Human papillomavirus vaccination and sexual behavior in young women. J Pediatr Adolesc Gynecol. 2014;27(2):67-71. 2. Hansen BT, Kjær SK, Arnheim-Dahlström L et al. Human papillomavirus (HPV) vaccination and subsequent sexual behaviour: evidence from a large survey of Nordic women. Vaccine. 2014;32(39):4945-53. 3. Ruiz-Sternberg AM, Pinzón-Rondón ÁM. Risk perception and sexual behavior in HPV-vaccinated and unvaccinated young Colombian women. Int J Gynaecol Obstet. 2014;126(3):205-8. 4. Kumakech E, Andersson S, Wabinga H et al. Cervical cancer risk perceptions, sexual risk behaviors and sexually transmitted infections among bivalent human papillomavirus vaccinated and non-vaccinated young women in Uganda – 5 year follow up study. BMC Womens Health. 2017;17(1):40.
Estudos de controle de casos e estudos transversais relataram que a prevalência da infecção pelo HPV de alto risco, a qual tem sido forte e consistentemente associada ao câncer de colo uterino, se eleva com o aumento do número de parceiros sexuais. Relatórios populares dessa última associação têm deixado a impressão na população de que a infecção pelo HPV seria adquirida como resultado de um comportamento sexual de risco e que as consequências psicossociais adversas de um diagnóstico da infecção pelo HPV seriam muito impactantes. No entanto, algumas jovens têm perguntado se, pelo fato de se manterem com um único parceiro sexual, poderiam ser excluídas da prescrição da vacina contra o HPV. Como demostrado pelos estudos a seguir, o fato de ter apenas um parceiro sexual não exclui o risco de infecção pelo HPV. Dessa maneira, sugere-se a aplicação da vacina para esse grupo de pacientes.1
Collins S e colaboradores relataram dados sobre um estudo no qual empregaram dados longitudinais de 242 mulheres que só tiveram um parceiro sexual na vida. Os autores verificaram que, no acompanhamento, 78 mulheres apresentaram resultado positivo para o HPV; 26 para um ou mais tipos de HPV de alto risco, 5 apenas para tipos de baixo risco e 47 para outros tipos não identificados. O risco cumulativo em três anos de adquirir uma infecção por HPV foi de 46% (intervalo de confiança [IC] de 95%: de 28 para 64%). Já o tempo médio entre a primeira relação sexual e a primeira detecção do HPV foi de 2,6 meses (intervalo de 0,3 a 59,0 meses). Concluem que para muitas mulheres a aquisição do HPV ocorre pouco tempo depois de começarem sua primeira relação sexual.1
Outro estudo, desenvolvido por Winer RL e colaboradores quantificou o risco de aquisição do HPV por jovens associado a um primeiro parceiro sexual masculino. Foram avaliados os dados de mulheres incluídas no estudo antes ou no período de 3 meses da primeira relação sexual com apenas um parceiro masculino e, na presença de um segundo parceiro, eram excluídas do estudo. A incidência cumulativa de 1 ano da primeira infecção por HPV foi de 28,5% (IC de 95%: de 20,6 a 38,6%) e aumentou para quase 50% em 3 anos. O risco aumentou quando o primeiro parceiro masculino teve experiência sexual. Os resultados indicam elevado risco de infecção por HPV em mulheres jovens que tiveram apenas um parceiro sexual masculino.2
Referências bibliográficas: 1. Collins S, Mazloomzadeh S, Winter H et al. High incidence of cervical human papillomavirus infection in women during their first sexual relationship. BJOG. 2002;109(1):96-8. 2. Winer RL, Feng Q, Hughes JP et al. Risk of female human papillomavirus acquisition associated with first male sex partner. J Infect Dis. 2008;197(2):279-82.
Muitos médicos atualmente informam a suas pacientes que a vacinação não traria benefícios a quem já foi infectado pelo HPV. É importante lembrar que, independentemente da idade, não é recomendado nenhum exame subsidiário (papanicolau, colposcopia ou rastreamento com teste de DNA de HPV, tipagem específica de HPV ou mensuração de anticorpos de HPV) para estabelecer a indicação da vacina contra o HPV. Os testes disponíveis para a detecção do HPV disponíveis apenas são capazes de detectar a presença do DNA ou do RNA do vírus no trato genital inferior. Infecções pregressas poderiam até mesmo serem detectadas pela presença de anticorpos séricos, no entanto, esse exame ainda não está comercialmente disponível.1
Quando uma paciente menciona que teve HPV no passado, não é possível dizer qual o tipo infectante prévio, nem se houve produção de anticorpos neutralizantes em níveis adequados para prevenir uma nova infecção pelo mesmo sorotipo.2 Por que então é importante vacinar quem já teve HPV?
Podemos descrever a seguir algumas razões favoráveis:
- Após terem eliminado uma infecção por determinado tipo de HPV, os indivíduos continuam sob risco de se contaminarem com um tipo diferente do HPV durante toda sua vida. O risco de infecção diminui com o progredir da idade, pela menor exposição ao vírus, mas ainda persiste. Nos últimos anos, observou-se um segundo pico na prevalência do HPV por volta dos 45 anos de idade. Tal pico poderia estar relacionado à aquisição de novos/múltiplos parceiros em idades mais avançadas e pela imunossenescência.3
- Uma infecção natural pelo HPV caracteriza-se pelo pouco acesso do vírus aos nódulos linfáticos, uma vez que se trata de uma infecção de ciclo eminentemente intraepitelial, sem viremia e disseminada a partir da superfície epitelial e/ou da mucosa. Em virtude desse tipo de resposta imune, diversos estudos publicados na literatura têm observado que a produção de anticorpos durante a infeção natural não ocorre em todos os indivíduos (média de 50%), sendo que os títulos de anticorpos induzidos são baixos e não duradouros. Dessa maneira, um determinado paciente poderá se infectar novamente pelo mesmo sorotipo viral a que já foi exposto. Ao contrário da infecção natural, as vacinas baseadas em virus-like particles (VLPs) são administradas por via intramuscular e alcançam rapidamente os vasos sanguíneos e os nódulos linfáticos locais. Por esse motivo, tais vacinas são muito imunogênicas (resposta de anticorpos com pico de 10 a 10.000 vezes maior que a gerada pela infecção natural), ativando fortemente as imunidades inata e adaptativa, gerando resposta importante e integrada. Dessa maneira, induz-se boa reação de células T-helper sobre as células B, aspecto fundamental para a produção de imunidade de memória. Assim, os pacientes produzirão anticorpos contra os 4 sorotipos contidos na vacina 4V (6,11,16 e 18) em aproximadamente 100% dos casos, diferentemente de uma infecção natural. Em um estudo comparativo com 2.617 mulheres com anticorpos positivos após infecção natural que foram divididas aleatoriamente para receber ou não a vacina 4V, a infecção natural pelo HPV não induziu resposta imune suficiente para impedir que os indivíduos do grupo placebo desenvolvessem doença subsequente relacionada àqueles tipos de HPV, mesmo na erradicação do vírus após infecção prévia. No grupo de mulheres vacinadas com a vacina 4V recombinante, houve indução de resposta adequada e prevenção de reinfecção ou reativação de doenças relacionadas aos HPVs contidos nela. Por exemplo, uma mulher que eliminou uma infecção pelo HPV 16 no passado, mostrou proteção contra doenças relacionadas a este sorotipo no acompanhamento.4-9
- A vacina pode conferir imunidade protetora contra o(s) tipo(s) viral(is) não adquirido(s) anteriormente. Nos estudos de eficácia da vacina 4V, observou-se que 20% das mulheres apresentaram contaminação por um dos tipos contidos na vacina. Os respectivos valores para da exposição a 2 ou 3 sorotipos foram de 6 e 1,2%, apenas de 0,1 a 0,3% das mulheres eram positivas para os 4 tipos do HPV (6,11,16 e 18), mostrando que a infecção múltipla é pouco frequente. Os resultados evidenciaram que a vacinação foi altamente eficaz na prevenção de neoplasia intraepitelial cervical (NIC) 2 ou 3, ou adenocarcinoma in situ (AIS) causados pelo tipo ou tipos do HPV para os quais as mulheres eram negativas no recrutamento.
Referências bibliográficas: 1. Federação Brasileira das Associações de Ginecologia e Obstetrícia (FEBRASGO). Rastreio, diagnóstico e tratamento do câncer de colo do útero. 2017. Disponível em: https://www.febrasgo.org.br/media/k2/attachments/05Z-ZDIANOySTICOZRASTREIOZEZTRATAMENTOZDOZCAyNCERZDEZCOLOZDEZUyTERO.pdf. Acessado em 04 de maio de 2021. 2. Martins NV, Campaner AB, Parellada CI et al. Patologia do trato genital inferior: diagnóstico e tratamento. São Paulo: Roca. 2 ed., 2014. 3. Muñoz N, Méndez F, Posso H et al; Instituto Nacional de Cancerologia HPV Study Group. Incidence, duration, and determinants of cervical human papillomavirus infection in a cohort of Colombian women with normal cytological results. J Infect Dis. 2004;190(12):2077-87. 4. Ho GY, Studentsov Y, Hall CB et al. Risk factors for subsequent cervicovaginal human papillomavirus (HPV) infection and the protective role of antibodies to HPV-16 virus-like particles. J Infect Dis. 2002;186(6):737-42. 5. Viscidi RP, Schiffman M, Hildesheim A et al. Seroeactivity to human papillomavirus (HPV) types 16, 18, or 31 and risk of subsequent HPV infection: results from a population-based study in Costa Rica. Cancer Epidemiol Biomarkers Prev. 2004;13(2):324-7. 6. Safaeian M, Porras C, Schiffman M et al; Costa Rican Vaccine Trial Group. Epidemiological study of anti-HPV16/18 seropositivity and subsequent risk of HPV16 and -18 infections. J Natl Cancer Inst. 2010;102(21):1653-62. 7. Garland SM, Smith JS. Human papillomavirus vaccines: current status and future prospects. Drugs. 2010;70(9):1079-98. 8. Stanley M. Introduction. The human papillomavirus VLP vaccines. Gynecol Oncol. 2010;118(1Suppl):S1. 9. Villa LL, Ault KA, Giuliano AR et al. Immunologic responses following administration of a vaccine targeting human papillomavirus types 6, 11, 16, and 18. Vaccine. 2006;24(27-28):5571-83. 10. FUTURE II Study Group. Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions. N Engl J Med. 2007;356(19):1915-27.
Quando uma paciente se infecta com algum tipo de HPV de baixo risco, principalmente os tipos 6 e 11, poderá desenvolver verrugas (condilomas) anogenitais. As mesmas se apresentam como lesões vegetantes, úmidas, isoladas ou agrupadas; podem acometer a uretra, vulva, mucosa genital (vagina, colo do útero), região perianal ou o canal anal.1
Existem diversos tipos de tratamento para os condilomas, incluindo principalmente os métodos químicos (ácido tricloroacético, podofilina, podofilotoxina, 5- FU), métodos físicos (eletrocauterização, crioterapia, laser) e imunoterapia (imiquimode). No entanto, todas as terapias estão associadas a reações cutâneas locais, incluindo coceira, queimação, erosão e dor. Os tratamentos disponíveis destroem as lesões, mas não conseguem eliminar o vírus do trato anogenital. Assim, recorrências podem ocorrer, incluindo novas lesões em locais previamente tratados ou novos locais, independentemente da terapia; as taxas de recorrências são muitas vezes de 20 a 30% ou maiores.2
Segundo os estudos da literatura, os HPV de baixo risco podem persistir por algum tempo no trato anogenital, em média de 12 meses. Nesse período, a paciente poderá desenvolver novas verrugas pela persistência viral, apesar do tratamento prévio. No futuro, essa mesma paciente poderá eliminar o vírus; no entanto, pela resposta imune à infecção natural, pode não ter formado anticorpos que previnam contra nova infecção e ela pode adquirir novamente o mesmo tipo ou outro de baixo risco e desenvolver novamente as verrugas.1
Estudos publicados mostram que a vacina contra HPV não acelera o clearance de HPV, não tem efeito negativo no curso de infecções já estabelecidas, bem como não tratará a infecção atual, isto é, os condilomas anogenitais, se presentes.3,4
No entanto, a administração da vacina 4V formará anticorpos caso a paciente não os tenha desenvolvido. Além disso, tem se verificado, por meio de estudos publicados, que a aplicação da vacina 4V em mulheres com história de condilomas, bem como naquelas em tratamento atual por verrugas anogenitais, poderia levar à redução do risco das recidivas dessas lesões. Desta maneira, a prescrição da vacina 4V para uma paciente com antecedentes de condilomas ou em tratamento atual dessas lesões seria de grande valia.3-9
Referências bibliográficas: 1. de Sanjosé S, Brotons M, Pavón MA. The natural history of human papillomavirus infection. Best Pract Res Clin Obstet Gynaecol. 2018;47:2-13. 2. Lacey CJ, Woodhall SC, Wikstrom A et al. 2012 European guideline for the management of anogenital warts. J Eur Acad Dermatol Venereol. 2013;27(3):e263-70. 3. Haupt RM, Wheeler CM, Brown DR et al; FUTURE I and II Investigators. Impact of an HPV6/11/16/18 L1 virus-like particle vaccine on progression to cervical intraepithelial neoplasia in seropositive women with HPV16/18 infection. Int J Cancer. 2011;129(11):2632-42. 4. Hildesheim A, Herrero R, Wacholder S et al; Costa Rican HPV Vaccine Trial Group. Effect of human papillomavirus 16/18 L1 viruslike particle vaccine among young women with preexisting infection: a randomized trial. JAMA. 2007;15;298(7):743-53. 5. FUTURE II Study Group. Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions. N Engl J Med. 2007;356(19):1915-27. 6. Petráš M, Adámková V. Impact of quadrivalent human papillomavirus vaccine in women at increased risk of genital warts burden: population-based cross-sectional survey of Czech women aged 16 to 40 years. Vaccine. 2015;33(46):6264-7. 7. Swedish KA, Goldstone SE. Prevention of anal condyloma with quadrivalent human papillomavirus vaccination of older men who have sex with men. PLoS One. 2014;9(4):e93393. 8. Jardine D, Lu J, Pang J et al. A randomized trial of immunotherapy for persistent genital warts. Hum Vaccin Immunother. 2012;8(5):623-9. 9. Joura EA, Garland SM, Paavonen J et al; FUTURE I and II Study Group. Effect of the human papillomavirus (HPV) quadrivalent vaccine in a subgroup of women with cervical and vulvar disease: retrospective pooled analysis of trial data. BMJ. 2012;344:e1401.
Quando uma paciente se infecta com algum tipo de HPV de alto risco oncogênico, principalmente os tipos 16 e 18, ela poderá uma neoplasia intraepitelial cervical (NIC), que pode ser de baixo grau histológico (NIC 1) ou de alto grau histológico (NICs 2 e 3). Para casos de NIC 1, a conduta recomendada seria o acompanhamento da paciente com exames a cada 6 meses por até 2 anos. Caso a lesão persista após esse período, recomenda-se o tratamento, que pode ser destrutivo ou excisional. No acompanhamento de uma NIC 1, quando se encontra 2 controles negativos, a paciente pode voltar ao rastreio de rotina. Em casos de NICs 2 e 3, a terapia preferencial é a excisional, por meio da exérese da zona de transformação ou conização cervical, dependendo das características da lesão. Em adolescentes e mulheres jovens, com idade inferior a 25 anos, pode-se optar pela conduta conservadora.1,2
No entanto, apesar do tratamento excisional para casos de NICs 2 e 3, a paciente pode apresentar recidivas da lesão (podendo ser mais que uma vez), com necessidade de novo procedimento excisional ou até mesmo evolução para um carcinoma invasivo do colo uterino e da vagina. Um importante estudo publicado por Strander B e colaboradores acompanhou 150.883 mulheres na Suécia diagnosticadas e tratadas por NIC 3, na busca de câncer invasivo cervical ou vaginal, e a mortalidade relacionada. A coorte compreendeu 3.148.222 de mulheres-anos. Observou-se que as mulheres previamente diagnosticadas e tratadas por NIC 3 apresentavam aumento do risco de morrer de câncer cervical ou vaginal invasivo em comparação à população feminina em geral. Esse risco aumentou desde a década de 1960 e é mais acentuado em mulheres com mais de 50 anos. O risco ainda persiste elevado 25 anos após o tratamento.3
Essas recidivas e até mesmo a invasão estromal estão principalmente associados à persistência do HPV de alto risco. Assim, há necessidade de vigilância estreita para esse grupo de pacientes. Entretanto, alguns estudos publicados na literatura têm evidenciado que a administração da vacina 4V poderia reduzir o risco de recidiva das lesões de NIC 2 e 3 após tratamento. Joura EA e colaboradores avaliaram o efeito da vacina 4V sobre o risco de desenvolvimento de doença subsequente após um procedimento excisional em casos de NIC. Um total de 587 mulheres vacinadas e 763 que receberam placebo foram submetidas à cirurgia cervical. A incidência de qualquer doença subsequente no colo uterino relacionada com o HPV foi de 6,6 e 12,2 nos grupos de estudo e placebo, respectivamente (redução de 46,2% com a vacinação). A vacinação foi associada a uma redução significativa do risco de desenvolvimento de qualquer doença de alto grau subsequente no colo do útero em 64,9% (de 20,1 a 86,3%), Figura 1.4-6
Além do estudo mencionado acima, podemos citar também os de Olsson SE e colaboradores, e Kang WD e colaboradores que também observaram redução nas recidivas de NIC após procedimento excisional, mediante à aplicação da vacina 4V.7,8 Do exposto, a prescrição da vacina 4V para uma paciente com antecedentes de tratamento por NIC deveria ser considerada.
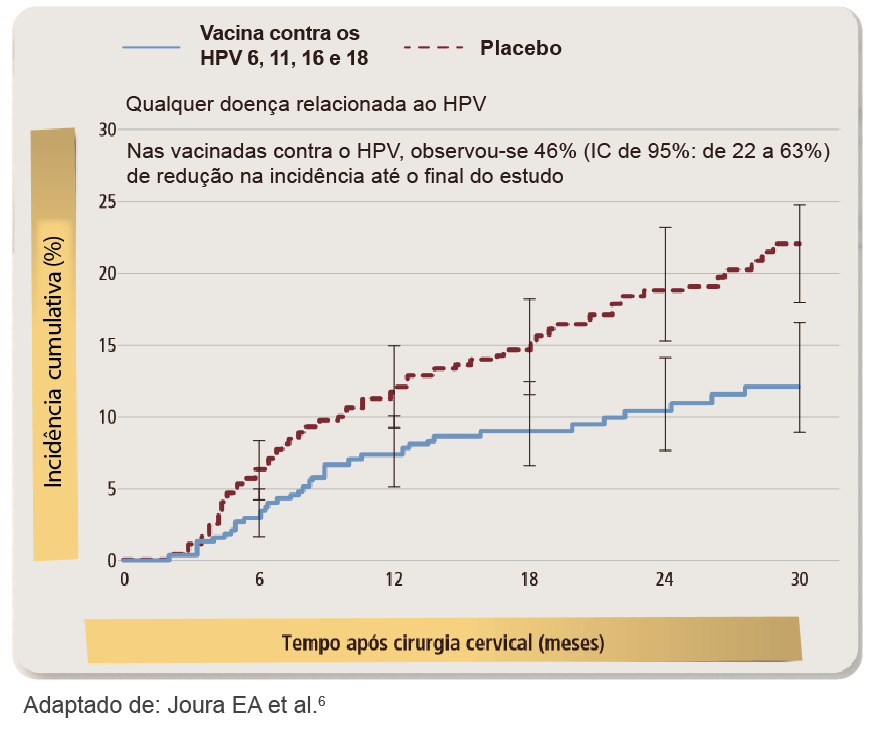
Figura 1. Redução no risco de recidivas de lesões no colo após procedimento e vacinação com a vacina 4V.
Referências bibliográficas: 1. de Sanjosé S, Brotons M, Pavón MA. The natural history of human papillomavirus infection. Best Pract Res Clin Obstet Gynaecol. 2018;47:2-13. 2. Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA). Diretrizes brasileiras para o rastreamento do câncer do colo do útero. 2016. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files//media/document//diretrizesparaorastreamentodocancerdocolodoutero_2016_corrigido. Acessado em 27 de abril de 2021. 3. Strander B, Andersson-Ellström A, Milsom I et al. Long term risk of invasive cancer after treatment for cervical intraepithelial neoplasia grade 3: population based cohort study. BMJ. 2007;335(7629):1077. 4. Vintermyr OK, Iversen O, Thoresen S et al. Recurrent high-grade cervical lesion after primary conization is associated with persistent human papillomavirus infection in Norway. Gynecol Oncol. 2014;133(2):159-66. 5. Bruhn LV, Andersen SJ, Hariri J. HPV-testing versus HPV-cytology co-testing to predict the outcome after conization. Acta Obstet Gynecol Scand. 2018;97(6):758-65. 6. Joura EA, Garland SM, Paavonen J et al; FUTURE I and II Study Group. Effect of the human papillomavirus (HPV) quadrivalent vaccine in a subgroup of women with cervical and vulvar disease: retrospective pooled analysis of trial data. BMJ. 2012;344:e1401. 7. Olsson SE, Kjaer SK, Sigurdsson K et al. Evaluation of quadrivalent HPV 6/11/16/18 vaccine efficacy against cervical and anogenital disease in subjects with serological evidence of prior vaccine type HPV infection. Hum Vaccin. 2009;5(10):696-704. 8. Kang WD, Choi HS, Kim SM. Is vaccination with quadrivalent HPV vaccine after loop electrosurgical excision procedure effective in preventing recurrence in patients with high-grade cervical intraepithelial neoplasia (CIN2-3)? Gynecol Oncol. 2013;130(2):264-8.
Nos sete estudos clínicos da vacina 4V, os participantes receberam a vacina ou placebo no dia da inclusão e aproximadamente 2 e 6 meses depois. Os voluntários incluíram 10.088 pessoas (6.995 meninas e mulheres de 9 a 45 anos de idade e 3.093 meninos e homens de 9 a 26 anos de idade na inclusão) que receberam a vacina, além de 7.995 voluntários que receberam placebo. Os principais eventos adversos (EA) relacionados à vacina, comparando-a com placebo, são apresentados nas tabelas 1 e 2.1
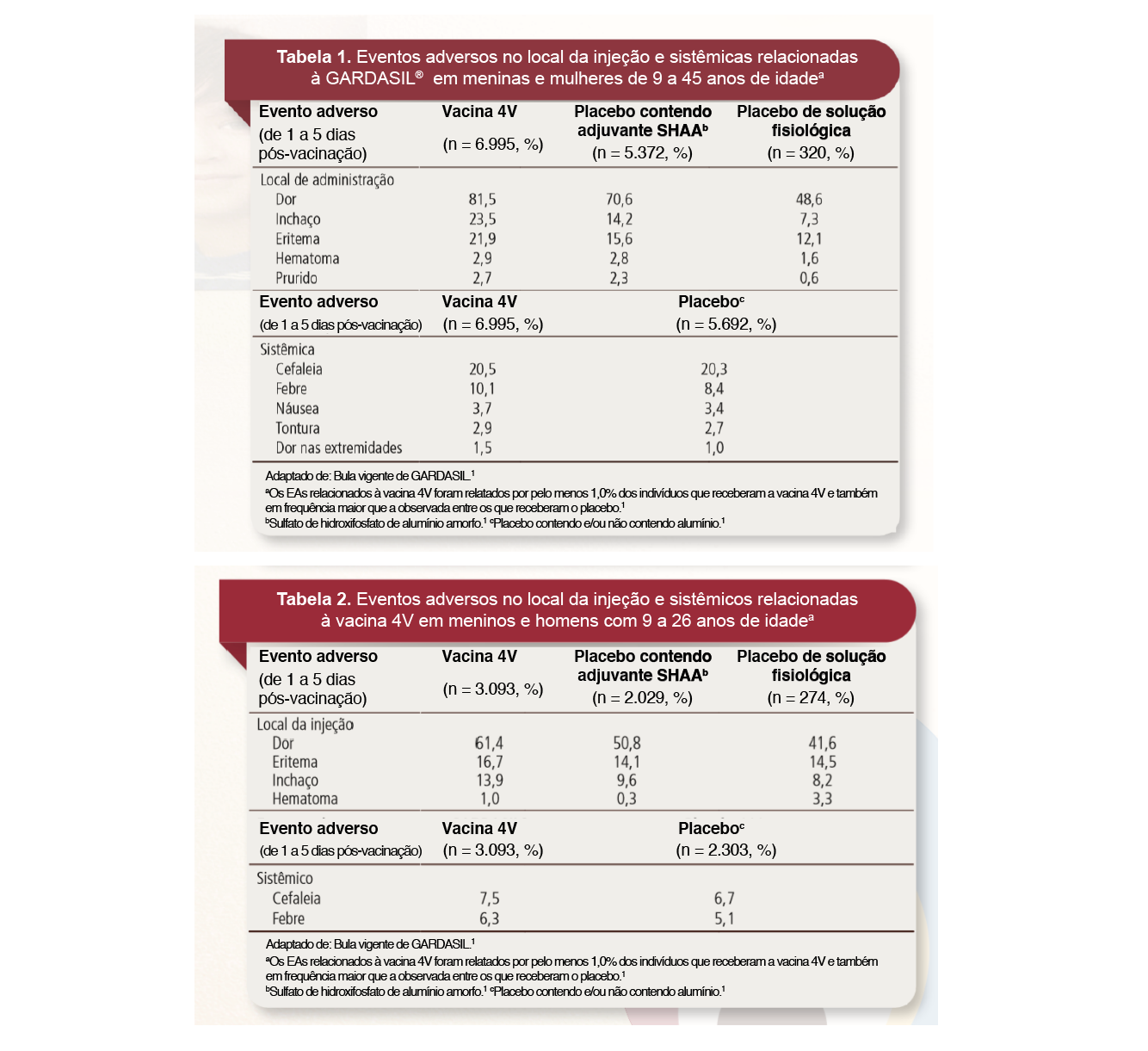
Pode-se verificar que os principais EAs foram aqueles relacionados ao sítio da injeção, principalmente dor, inchaço e eritema.1
Em relação aos EAs graves na população total do estudo, de um total de 29.323 indivíduos, 258 (meninas e mulheres de 9 a 45 anos de idade e meninos e homens de 9 a 26 anos de idade) que receberam a vacina e placebo relataram um EA sistêmico grave após qualquer visita de vacinação durante os estudos clínicos. Dos EA sistêmicos graves, somente 0,04% foram considerados relacionados à vacina pelos pesquisadores do estudo. Os EA sistêmicos graves mais frequentemente relatados com o uso da vacina 4V em comparação com o placebo e independentemente da causalidade foram:1
- Cefaleia [0,02% para vacina 4V (3 casos) versus 0,02% para placebo (2 casos)],
- Gastrenterite [0,02% para vacina 4V (3 casos) versus 0,02% para placebo (2 casos)],
- Apendicite [0,03% para vacina 4V (5 casos) versus 0,02% para placebo (1 caso)],
- Doença inflamatória pélvica [0,02% para vacina 4V (3 casos) versus 0,03% para placebo (4 casos)],
- Infecção do trato urinário [0,01% para vacina 4V (2 casos) versus 0,01% para placebo (2 casos)],
- Pneumonia [0,01% para vacina 4V (2 casos) versus 0,02% para placebo (2 casos)],
- Pielonefrite [0,01% para vacina 4V (2 casos) versus 0,02% para placebo (3 casos)],
- Embolia pulmonar [0,01% para vacina 4V (2 casos) versus 0,02% para placebo (2 casos)],
- Um caso de broncoespasmo (0,006% para vacina 4V: 0,0% para placebo) e dois casos de asma (0,01% para vacina 4V: 0,0% para placebo).
Referência bibliográfica: 1. Bula vigente de GARDASIL.
A Organização Mundial da Saúde (OMS) e o Conselho Consultivo para Práticas de Imunizações (ACIP), órgão dos Centers of Disease Control and Prevention [CDC] e Food and Drug Administration (FDA), ressaltam em seus relatórios que a vacina 4V contra HPV possui bom perfil de segurança. A maioria dos EAs se restringiu ao local da injeção, sendo de intensidade leve a moderada. Nos estudos clínicos, reações locais leves e temporárias no local da injeção (eritema, dor e inchaço) foram 10-20% mais frequentes entre os indivíduos vacinados em comparação aos grupos controle; nenhum EA sistêmico relatado teve relação causal com a imunização contra o HPV. Os CDC e o FDA possuem sistema de vigilância de EAs nos EUA denominado Vaccine Adverse Event Reporting System (VAERS) – que é constantemente atualizado e disponível no https://www.cdc.gov/vaccinesafety/vaccines/hpv-vaccine.html/. Qualquer problema detectado com a vacina será reportado para que providências sejam tomadas.1-3
Em 2014, o CDC publicou um relatório analisando os eventos de saúde relatados ao VAERS após a vacinação com a vacina 4V de junho de 2006 a março de 2014. Cerca de 92% dos relatos foram classificados como não graves. Os EAs mais comumente relatados foram: síncope (desmaios), tonturas, náusea, dor de cabeça, febre, reações do local de injeção (dor, inchaço e vermelhidão). Embora raros, desmaios ocorreram após a vacinação contra o HPV. Em resposta, o FDA alterou a orientação para que os médicos incluíssem informações sobre a prevenção de quedas e lesões por desmaio. O CDC e o Comitê Consultivo de Práticas de Imunização incluíram essa orientação nas recomendações para a vacinação contra HPV. Com base nessas recomendações, os profissionais de saúde devem administrar vacinas contra HPV enquanto o paciente estiver sentado ou deitado. O paciente deve permanecer sentado e ser observado por 15 minutos. O CDC continua a lembrar médicos e profissionais de enfermagem para observar essa orientação e compartilhar essas informações com todos os seus pacientes.4
Mais de 100 milhões de doses de vacinas contra o HPV foram distribuídas nos EUA de junho de 2006 a dezembro de 2017. Até o momento, a maior parte da monitoração e pesquisa de segurança de vacinas contra o HPV no CDC tem focado na vacina 4V, visto que representou a maioria das doses de vacina contra o HPV distribuídas no EUA. Entre todos os relatos ao VAERS após a vacina contra o HPV, os sintomas mais frequentemente relatados em geral foram tonturas; desmaios; dores de cabeça; náuseas; febre; e dor, vermelhidão e inchaço no braço em que a vacina foi aplicada. Dos relatórios para a VAERS, 6% foram classificados como “graves”. Cerca de 22% dos relatórios da VAERS não estavam relacionados a problemas de saúde, mas foram relatados por razões como o armazenamento inadequado de vacinas ou a vacina sendo administrada a alguém para quem ela não era não recomendada. Desde seu licenciamento, em junho de 2006, até dezembro de 2017, mais de 80 milhões de doses da vacina 4V foram distribuídas nos EUA. Durante o mesmo período, a VAERS recebeu 36.142 relatórios estadunidenses de EAs após a vacinação com a vacina 4V. No geral, 93% foram de relatos não graves; 7% dos relatórios foram classificados como graves.2
Em resumo, a vacina 4V contra o HPV é segura? Sim. O perfil de segurança da vacina 4V contra o HPV foi bem estudada. Antes de ter sido licenciada pelo FDA e pela ANVISA, a vacina passou por anos de testes por meio de ensaios clínicos para garantir o seu perfil de segurança. Após o licenciamento, o monitoramento do perfil de segurança pelo CDC e FDA continua a procurar problemas raros ou novos que possam ocorrer após a vacinação. Uma vez que a vacina ficou disponível em 2006, houve grandes estudos de perfil de segurança realizados nos EUA e outros países, com resultados tranquilizadores. Não houve sinais de problemas confirmados (ou seja, maior do que o esperado de EAs) observados, com exceção da síncope (desmaio). O CDC continua a monitorar a segurança das vacinas contra o HPV e fornece atualizações ao Advisory Committee on Immunization Practices (ACIP), bem como ao Comitê Consultivo Global da OMS para a Segurança das Vacinas (GACVS).5
Referências bibliográficas: 1. Martins NV, Campaner AB, Parellada CI et al. Patologia do trato genital inferior: diagnóstico e tratamento. São Paulo: Roca. 2 ed., 2014. 2. Centers for Disease Control and Prevention (CDC). Questions about HPV vaccine safety. 2020. Disponível em: https://www.cdc.gov/vaccinesafety/vaccines/hpv/hpv-safety-faqs.html. Acessado em 27 de abril de 2021. 3. Centers for Disease Control and Preventios (CDC). Vaccine safety. Human papillomavirus (HPV) vaccine. Disponível em: https://www.cdc.gov/vaccinesafety/vaccines/hpv-vaccine.html/. Acessado em 05 de maio de 2021. 4. Markowitz LE, Dunne EF, Saraiya M et al. Human papillomavirus vaccination: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2014;63(RR05):1-30. 5. Bula vigente de GARDASIL.
Clique aqui para fazer o download da Bula do Profissional
Clique aqui para fazer o download da Bula do Paciente