Associação de aminoglicosídeos e polipeptídicos catiônicos e Caso Clínico: Uma análise das abordagens terapêuticas
CASO CLÍNICO
ZERBAXA VS
POLIMIXINA+AMICACINA
DR. RICARDO CORDIOLI
CRM 109363-SP | RQE: 33.866
Médico pesquisador e plantonista da UTI-Adulto do Hospital Israelita Albert Einstein; Coordenador da Pós-Graduação lato sensu em Terapia Intensiva Adulto para Médicos do Ensino Einstein; Pós-Doutorado pela Universidade de Genebra
CASO CLÍNICO
ZERBAXA VS. POLIMIXINA + AMICACINA
É importante pontuar que, em outubro de 2021, o Surviving Sepsis Campaign (SSC) particularizou o tempo ideal para início da antibioticoterapia, não a indicando em até uma hora para todos os casos. Confira a recomendação modificada:
Tabela 1. TEMPO PARA ADMINISTRAÇÃO DE ANTIMICROBIANOS NA SEPSE (SSC, 2021)

ATB: antibiótico.
Adaptado de Evans L, et al.1
ESCOLHA DO ESQUEMA ANTIMICROBIANO
ALTO RISCO DE INFECÇÃO POR:

ATB: antibiótico
Adaptado de Evans L, et al.1
FIGURA 1. PILARES DA ANTIBIOTICOTERAPIA NO PACIENTE COM SEPSE OU CHOQUE SÉPTICO
A SOBREVIDA DO PACIENTE COM SEPSE É REDUZIDA EM 7,6% PARA CADA HORA SEM ANTIBIOTICOTERAPIA EFETIVA.2

Acertar a terapia empírica logo na primeira escolha não é tarefa fácil. É fato conhecido que quase metade dos casos tem escolhas inadequadas, levando a maior tempo de hospitalização, custo do tratamento e aumento de 50% na mortalidade.3,4
Frequentemente é observado que o erro empírico ocorre em pacientes com maior gravidade com exposição prévia a outros antibióticos, favorecendo a infecção por MDRs.5
ESCOLHA DO ANTIBIÓTICO ADEQUADO
CONSIDERA6:
- História clínica e gravidade do paciente
- Síndrome clínica ou sítio suspeito
- Comorbidades existentes
- Insuficiência renal e hepática
- Interações com medicamentos de uso prévio
- Invasões presentes
IMUNOSUPRESSÃO? COLONIZAÇÃO? USO RECENTE DE ATB?6
- Presença de imunossupressão com aumento de risco para alguns patógenos
- Uso recente de antimicrobianos e colonização com MDRs
AONDE ESTAVA E ONDE ESTÁ O PACIENTE6:
- Presença de imunossupressão com aumento de risco para alguns patógenos
- Uso recente de antimicrobianos e colonização com MDRs
PRINCIPAIS SÍTIOS DE INFECÇÃO E MICRORGANISMOS RESPONSÁVEIS
É fundamental conhecer a epidemiologia hospitalar da UTI local para acertar a terapia empírica.
O estudo EPIC III avaliou a prevalência e as características das infecções de UTIs em todo o mundo.7
15.202 PACIENTES INCLUÍDOS
MULTICÊNTRICO, 15.202 PACIENTES, BRASIL COMO TERCEIRO MAIOR CONTRIBUINTE
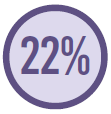
1.760 com infecção adquirida na UTI
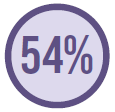
8.135 tinham suspeita ou infecção comprovada
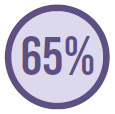
5.259 tinham ao menos uma cultura positiva
INFECÇÃO ADQUIRIDA NA UTI ASSOCIADA À MAIOR MORTALIDADE EM COMPARAÇÃO ÀS OUTRAS (OR: 1,32 [IC95%, 1,10-1,60]; P = 0,003).7
SÍTIO DE INFECÇÃO MAIS PREVALENTES
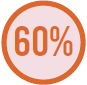
Infecção de trato respiratório
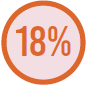
Infecção intrabdominal

Infecção de corrente sanguínea
MICROORGANISMOS MAIS PREVALENTES
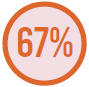
Bactérias Gram-negativas
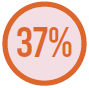
Bactérias Gram-positivas
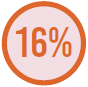
Fungos
Das bactérias, Pseudomonas aeruginosa e Klebsiella pneumoniae foram as mais frequentemente isoladas.
Adaptado de Vincent JL, et al.7
FARMACOCINÉTICA E FARMACODINÂMICA DO ANTIBIÓTICO
É fundamental conhecer sobre a penetração do ATB no sítio infectado, além da sua distribuição, transporte e metabolismo nos pacientes tratados.8
A penetração da colistina no FEP após administração IV não foi extensivamente estudada, porém, um estudo clínico não conseguiu detectar a presença desse antibiótico no FEP de pacientes críticos com pneumonia associada à ventilação mecânica (PAV) após 2 dias da administração IV a cada 8 horas.9
Nas infecções pulmonares, o antibiótico deve apresentar boa penetração no fluido epitelial pulmonar (FEP). Escolher medicamentos que mantenham não somente nível sérico, mas também concentração alveolar, é essencial para o sucesso do tratamento das pneumonias.8
De forma semelhante, os aminoglicosídeos também têm baixa concentração no FEP, mesmo na presença de elevados níveis séricos. Desta forma, o uso de aminoglicosídeos em monoterapia para o tratamento de pneumonias não é recomendado.9
PSEUDOMONAS AERUGINOSA
É UM GRAM-NEGATIVO NÃO FERMENTADOR E, JUNTO COM ENTEROBACTÉRIAS (COMO KLEBSIELLA SP.) ESTÁ ENTRE OS PRINCIPAIS MICRORGANISMOS QUE CAUSAM INFECÇÃO EM PACIENTES CRÍTICOS.7,10,11
A Pseudomonas aeruginosa pode acumular diferentes mecanismos de resistência, os quais inclusive podem emergir durante o tratamento. Na suspeita de falha clínica, reavaliar o o teste de sensibilidade de novas amostras é essencial.12,13
Um artigo de revisão demonstrou que, contra Pseudomonas aeruginosa, a ceftolozana-tazobactam pode ser uma opção terapêutica válida para o tratamento de infeções multirresistentes, pan-resistentes e resistentes a carbapenêmicos.14
Uma diretriz recente da American Society of Infectious Diseases (IDSA) sobre o tratamento de infecções por bactérias Gram-negativas ressalta que a ceftolozana-tazobactam está entre os tratamentos preferenciais para a P. aeruginosa de difícil tratamento (DRT) em pacientes críticos ou naqueles com controle inadequado de isolados da fonte de infecção por P. aeruginosa resistente a carbapenêmicos mas susceptível aos ß-lactâmicos tradicionais.15
UM ESTUDO AMERICANO ANALISOU 1.576 AMOSTRAS DE P. aureginosa ISOLADAS DE PACIENTES COM PNEUMONIA

Adaptado de Castanheira M, et al.16
Para combate às bactérias Gram-negativas multirresistentes, além dos betalactâmicos e carbapenêmicos, ainda é possível utilizar aminoglicosídeos e/ou de polimixina, seja polimixina B ou colistina.13 Entretanto, tais classes de ATBs apresentam muitos efeitos colaterais, sobretudo nefrotoxicidade e ototoxicidade muitas vezes irreversíveis com a suspensão do tratamento.17,18 Soma-se ao fato que tais antibióticos também apresentam farmacodinâmica e/ou farmacocinética desfavorável e, assim, temos poucos dados sobre a real eficácia da associação entre aminoglicosídeos e polimixina para tratamento de infecções em pacientes críticos.19-21
Há estudos que compararam a eficácia e o perfil de segurança de tratamentos baseados na ceftolozana-tazobactam (C/T) versus regimes com base em polimixina ou aminoglicosídeos para tratamento de pacientes críticos por infecções com P. aeruginosa multirresistente multirresistente. Um estudo com 200 pacientes demonstrou menor taxa de dano renal e maiores taxas de cura clínica a favor do regime C/T, mas sem diferença de mortalidade. No entanto, vale salientar que 72% dos pacientes tratados com polimixina ou aminoglicosídeos receberam algum outro ATB e apenas 15% dos pacientes do grupo C/T receberam outro ATB concomitante.21
Um estudo mais recente identificou mortalidade 61% menor hospitalar no grupo tratado com C/T quando comparado ao tratado com o grupo tratado com polimixina ou aminoglicosídeos.22
CASO CLÍNICO
01
Paciente do sexo masculino, 68 anos de idade, com hipertensão arterial, obesidade, diabetes mellitus, internação recente por colecistite, e que ficara internado durante 1 mês. Retornou ao hospital após 2 meses, com quadro de dor abdominal, secundário a abdômen agudo obstrutivo e novamente apresentou internação prolongada, de mais de 3 meses.
02
A internação foi complicada por choque séptico com disfunção de múltiplos órgãos, levando à necessidade de altas doses de vasoativos, terapia renal substitutiva e ventilação mecânica. O paciente posteriormente evoluiu com pneumonia associada à ventilação, além de síndrome do desconforto respiratório agudo.
03
Vale ressaltar que esse paciente apresentava diversos fatores de risco para PAV causada por bactéria multirresistente.23
04
Devido ao uso prévio de ATBs, optou-se por início empírico de meropeném e vancomicina, considerando a epidemiologia local.
D0: Cultura de secreção traqueal Pseudomonas aeruginosa
| CEFTAZIDIMA | RESISTENTE |
| CEFEPIMA | RESISTENTE |
| MEROPENÉM | RESISTENTE |
| IMIPENÉM | RESISTENTE |
Nas 72 horas iniciais após a troca da antibioticoterapia, o paciente evoluiu com melhora clínica, porém, voltou a apresentar febre, com piora dos parâmetros ventilatórios e aumento da secreção traqueal.
D5: Cultura de secreção traqueal Pseudomonas aeruginosa
O paciente permaneceu taquicárdico, subfebril e com aumento de proteína C reativa, apesar de 48 horas de terapia. Foi solicitada ampliação do teste de susceptibilidade a antimicrobianos para agentes não testados e o esquema foi trocado de meropeném e vancomicina para polimixina, amicacina e linezolida.
RESULTADO DO TESTE DE SENSIBILIDADE AMPLIADO:
| CEFTOLOZANA-TAZOBACTAM | SENSÍVEL |
| POLIMIXINA B | SENSÍVEL |
| CEFTAZIDIMA | RESISTENTE |
| CEFEPIMA | RESISTENTE |
| MEROPENÉM | RESISTENTE |
| IMIPENÉM | RESISTENTE |
| CEFTOLOZANA-TAZOBACTAM | SENSÍVEL |
| POLIMIXINA B | RESISTENTE |
Após resultados de cultura, optou-se então por trocar a polimixina B e a amicacina por ZERBAXA (ceftolozana-tazobactam), levando à recuperação clínica e à redução de biomarcadores do paciente, conforme gráfico abaixo:
O tratamento com ZERBAXA foi mantido por 10 dias, levando à melhora clínica do paciente e consequente alta da UTI após alguns dias.

REFERÊNCIAS
- Evans L, Rhodes A, Alhazzani W, et al. Executive Summary: Surviving Sepsis Campaign: International Guidelines for the Management of Sepsis and Septic Shock 2021. Crit Care Med.
2021;49(11):1974-82. - Kumar A, Roberts D, Wood KE, et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med.
2006;34(6):1589-96. - Marquet K, Liesenborgs A, Bergs J, Vleugels A, Claes N. Incidence and outcome of inappropriate in-hospital empiric antibiotics for severe infection: a systematic review and meta-analysis. Crit Care.
2015;19(1):63. - Raman G, Avendano E, Berger S, Menon V. Appropriate initial antibiotic therapy in hospitalized patients with gram-negative infections: systematic review and meta-analysis. BMC Infect Dis.
2015;15:395. - Bonine NG, Berger A, Altincatal A, et al. Impact of Delayed Appropriate Antibiotic Therapy on Patient Outcomes by Antibiotic Resistance Status From Serious Gram-negative Bacterial Infections. Am J
Med Sci. 2019;357(2):103-10. - Ramasco F, Méndez R, la Rica AS, et al. Sepsis Stewardship: The Puzzle of Antibiotic Therapy in the Context of Individualization of Decision Making J Pers Med . 2024 Jan 18;14(1):106. doi: 10.3390/
jpm14010106. - Vincent JL, Sakr Y, Singer M, et al. Prevalence and Outcomes of Infection Among Patients in Intensive Care Units in 2017. JAMA. 2020;323(15):1478-87.
- Välitalo PA, Griffioen K, Rizk ML, et al. Structure-Based Prediction of Anti-infective Drug Concentrations in the Human Lung Epithelial Lining Fluid. Pharm Res. 2016;33(4):856-67.
- Heffernan AJ, Sime FB, Lipman J, et al. Intrapulmonary pharmacokinetics of antibiotics used to treat nosocomial pneumonia caused by Gram-negative bacilli: A systematic review. Int J Antimicrob
Agents. 2019;53(3):234-45. - Vincent JL, Rello J, Marshall J, et al. International study of the prevalence and outcomes of infection in intensive care units. JAMA. 2009;302(21):2323-9.
- Silva E, Dalfior Junior L, Fernandes HaS, Moreno R, Vincent JL. Prevalence and outcomes of infections in Brazilian ICUs: a subanalysis of EPIC II study. Rev Bras Ter Intensiva. 2012;24(2):143-50.
- Wood SJ, Kuzel TM, Shafikhani SH. Pseudomonas Aeruginosa: Infections, Animal Modeling, and Therapeutics. Cells. 2023;12(1).
- Bassetti M, Vena A, Croxatto A, Righi E, Guery B. How to manage Pseudomonas aeruginosa infections. Drugs Context. 2018;7:212527.
- Giaccari LG, Pace MC, Passavanti MB, Gargano F, Aurilio C, Sansone P. Ceftolozane/Tazobactam for Resistant Drugs Pseudomonas aeruginosa Respiratory Infections: A Systematic Literature Review of
the Real-World Evidence. Life (Basel). 2021 May 24;11(6):474. - Tamma PD, Aitken SL, Bonomo RA, et al. Infectious Diseases Society of America 2023 Guidance on the Treatment of Antimicrobial Resistant Gram-Negative Infections. Clin Infect Dis. 2023 Jul
18:ciad428. - Castanheira M, Duncan LR, Mendes RE, Sader HS, Shortridge D. Activity of Ceftolozane-Tazobactam against Pseudomonas aeruginosa and Enterobacteriaceae Isolates Collected from Respiratory Tract
Specimens of Hospitalized Patients in the United States during 2013 to 2015. Antimicrob Agents Chemother. 2018;62(3). - Oliveira JF, Silva CA, Barbieri CD, Oliveira GM, Zanetta DM, Burdmann EA. Prevalence and risk factors for aminoglycoside nephrotoxicity in intensive care units. Antimicrob Agents Chemother.
2009;53(7):2887-91. - Oliota AF, Penteado ST, Tonin FS, Fernandez-Llimos F, Sanches AC. Nephrotoxicity prevalence in patients treated with polymyxins: a systematic review with meta-analysis of observational studies.
Diagn Microbiol Infect Dis. 2019;94(1):41-9. - Vidal L, Gafter-Gvili A, Borok S, Fraser A, Leibovici L, Paul M. Efficacy and safety of aminoglycoside monotherapy: systematic review and meta-analysis of randomized controlled trials. J Antimicrob
Chemother. 2007;60(2):247-57. - O’Donnell JN, Bidell MR, Lodise TP. Approach to the Treatment of Patients with Serious Multidrug-Resistant Pseudomonas aeruginosa Infections. Pharmacotherapy. 2020;40(9):952-69.
- Pogue JM, Kaye KS, Veve MP, et al. Ceftolozane/Tazobactam vs Polymyxin or Aminoglycoside-based Regimens for the Treatment of Drug-resistant Pseudomonas aeruginosa. Clin Infect Dis.
2020;71(2):304-10. - Caffrey AR, Appaneal HJ, Liao JX, et al. The Comparative Effectiveness of Ceftolozane/Tazobactam versus Aminoglycoside- or Polymyxin-Based Regimens in Multi-Drug-Resistant. Antibiotics (Basel).
2022;11(5). - Kalil AC, Metersky ML, Klompas M, et al. Management of Adults With Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of
America and the American Thoracic Society. Clin Infect Dis. 2016;63(5):e61-e111.
Projeto editorial, produção gráfica e copyrights:

Rua das Roseiras, 464
CEP 03144-090 – São Paulo-SP
Tel.: (11) 2341-8045
E-mail: contato@alamtec.com.br | www.alamtec.com.br
© 2024 AlamTec – Ciência Médica Editorial Ltda.
Todos os direitos reservados.
O conteúdo desta publicação é de responsabilidade exclusiva de seu(s) autor(es) e não reflete necessariamente a posição da AlamTec – Ciência Médica Editorial Ltda.
Este conteúdo é oferecido pela MSD como um serviço à comunidade médica. Os pontos de vista aqui expressos refletem a experiência e as opiniões dos autores. As informações relacionadas a produto(s) podem ser divergentes das existentes na Circular aos Médicos (bula). Antes de prescrever qualquer medicamento eventualmente citado, recomendamos a leitura da Circular aos Médicos emitida pelo fabricante.
Nenhuma parte deste material poderá ser reproduzida ou transmitida, sejam quais forem os meios empregados, sem a autorização prévia por escrito da AlamTec – Ciência Médica Editorial Ltda.
As informações requeridas pelo art. 27 da RDC 96/08 (minibula de ZERBAXA) podem ser acessadas clicando aqui
Ressaltamos que ZERBAXA® é contraindicado para pacientes com hipersensibilidade a qualquer agente antibacteriano cefalosporínico e hipersensibilidade grave (p. ex., reação anafilática ou reação cutânea grave) a qualquer um dos tipos de agente antibacteriano betalactâmico (p. ex., penicilinas ou carbapenéns). Não são previstas interações medicamentosas com ZERBAXA® e substratos, inibidores e indutores das enzimas do citocromo P-450 com base em estudos in vivo e in vitro.
Antes de prescrever o produto, recomendamos a leitura da bula completa para informações detalhadas.
SE PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO.
Material exclusivo para profissionais de saúde habilitados a prescrever ou dispensar medicamentos.
Copyright © 2024 Merck & Co., Inc., Rahway, NJ, EUA, e suas afiliadas. Todos os direitos reservados.
BR-ZER-00316 PRODUZIDO EM MAIO/2022 VÁLIDO POR 2 ANOS